
Secciones
Servicios
Destacamos

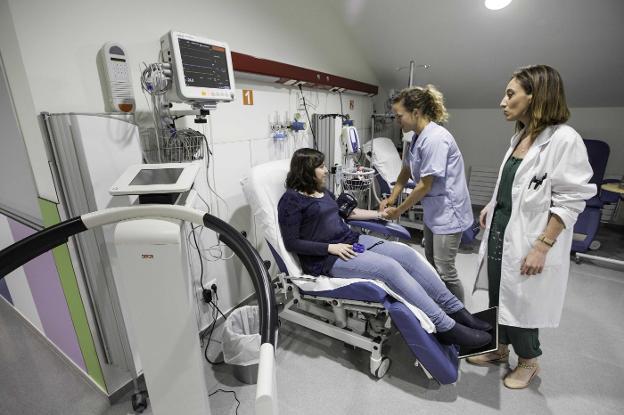
En el complejo hospitalario de Valdecilla hay un rincón que pasa casi inadvertido en la vorágine de un centro que mueve miles de pacientes cada día. Pero para un puñado de cántabros aloja la esperanza de hallar la curación que otros medicamentos no han logrado aún. Una ventana al futuro farmacológico que está por venir, donde se prueban por primera vez en humanos moléculas antes solo experimentadas en animales o en laboratorio. La Unidad de Ensayos Clínicos es la piedra angular entre la investigación y la asistencia, donde participan anualmente más de 350 pacientes, de la mano de los profesionales del hospital, bajo la batuta del Idival. Ese espacio, casi blindado por meticulosas medidas de seguridad, se encuentra en la segunda planta del pabellón 15 de Valdecilla.
Blanca Sánchez | Farmacología Clínica
En la actualidad, trabajan en 70 ensayos clínicos, la mayoría en fase I (de las cuatro en las que se estructura el proceso previo a la comercialización del producto), que es la primera administración en humanos, donde «se comprueba cómo se comporta en el organismo, cómo se absorbe y se distribuye», a la vez que se analizan sus posibles efectos secundarios. Se trata, en definitiva, del primer paso para medir que un nuevo fármaco es seguro.
«Aunque se suele hacer en voluntarios sanos, nosotros hasta el momento no hemos tenido ningún ensayo de ese tipo, sino que testamos directamente en pacientes», explica Blanca Sánchez, farmacóloga clínica responsable de esta unidad centrada en fases tempranas (I y II), que «son las de mayor riesgo para el humano». Desde que inició su actividad, hace cinco años, ha experimentado una «importante progresión», incorporando estudios de prácticamente todas las especialidades no quirúrgicas del hospital, que «era uno de los objetivos que nos marcamos». «Digestivo fue el primer servicio en traspasar su actividad a la Unidad -el ensayo de hepatitis C fue una auténtica revolución-, pero hoy en día tenemos estudios de Alergología, Respiratorio, Medicina Interna, Cardiología, Reumatología, Infecciosas, Neurología... incluso de Urología, que antes no tenía experiencia en ensayos clínicos, ya está dentro», celebra Sánchez. El planteamiento del ensayo parte casi siempre del laboratorio fabricante, que busca su anclaje en los centros a través de un investigador principal.
1. Es la primera administración en humanos de moléculas solo probadas en animales y laboratorio (in vitro) para comprobar su seguridad.
2. Se amplía la lista de candidatos, de la docena de la primera al centenar, para ver si el fármaco funciona e identificar posibles reacciones adversas.
3. Se amplía el ensayo a una muestra de pacientes mucho mayor, donde se comparan los resultados del tratamiento estándar con el nuevo fármaco.
4. Es la fase previa a la comercialización o incluso postcomercialización, donde se sigue analizando el impacto y si tiene efectos secundarios.
1200 asistencias realizó la Unidad el año pasado a los más de 350 pacientes que participaron en los diferentes ensayos clínicos en curso. En lo que va de 2018, se han abierto 14 estudios nuevos.Ahora hay activos 70.
«Hay hospitales que no tienen unidad de ensayos clínicos en fases tempranas, y se realizan directamente en planta, pero el problema es que el ratio de médicos y enfermeras tiene que ser más alto cuando atiendes un ensayo clínico, primero por el riesgo para el paciente desde el punto de vista de toxicidad y, segundo, porque los procedimientos marcados en el protocolo del ensayo son muy complejos, exigen cumplir los tiempos establecidos con ventanas muy estrechas». De hecho, garantizar el cumplimiento «escrupuloso» de esos protocolos es el requisito número uno que demandan los promotores de los ensayos, que «en el 99% de los casos es la industria farmacéutica. El otro 1% es investigación independiente, el propio investigador que se tiene que buscar fuentes de financiación, como convocatorias competitivas».
La Unidad permite centralizar la atención «en un entorno controlado», que es un punto de referencia para el paciente. «Si tiene cualquier evento adverso, quien lo atiende en primera línea es la Unidad, aunque en cuanto se detecta se avisa al investigador principal. De esta forma se evita que vaya dando vueltas por el hospital para realizarse las diferentes pruebas de seguimiento».
«Hablamos de estudios multicéntricos», que se realizan a nivel internacional para después comparar los resultados. Por ello, requiere que todo el aparataje sea homogéneo -el laboratorio que financia el ensayo se encarga de facilitarlo-. Y también las muestras que se toman a los pacientes se remiten a laboratorios centralizados, ya sea en Suiza, Bélgica, Irlanda... «El promotor proporciona los kit en los que debemos remitir esas muestras, ya sea a temperatura ambiente o en neveras. Y salen directamente desde la Unidad», que está certificada por la ISO 9001, que «nos exige procedimientos normalizados para todo».
En sus dependencias, dispone de dos habitaciones, con cuatro camas, y de todo el equipamiento necesario para el control de estos enfermos, expuestos a «un riesgo parcialmente conocido, que es bastante alto. Todos los datos que tenemos vienen de la investigación preclínica, es decir, en animales o en laboratorio (in vitro). Hay moléculas de las que ya conocemos su perfil de forma indirecta, y otras que son nuevas, por lo que el riesgo es desconocido», explica Sánchez. Mientras que en la primera fase del ensayo se selecciona a un pequeño grupo de pacientes (entre doce y quince), en la segunda la cifra aumenta hasta la centena, «con el objetivo de identificar aquellas reacciones que tienen una baja frecuencia de aparición en población y que pueden no haber dado la cara precisamente por ser reducida la muestra».
La participación es totalmente voluntaria y gratuita. «La legislación española solo permite que sean los voluntarios sanos los que cobren por pretarse a ensayos clínicos, porque en ese supuesto el estudio no tendría beneficio terapéutico (no se tienen que curar), por lo que cabe una compensación económica», explica la farmacóloga clínica. Si esa vía se abriera, se publicaría un anuncio a través de la web del Idival, con el respaldo del comité de ética, y se les realizaría la correspondiente batería de pruebas para conformar un registro de candidatos. En los centros donde hay experiencias de este tipo, se suele reclutar en la Facultad de Medicina. Cuando el ensayo pasa a la fase III la extensión de ese fármaco en pruebas es mucho mayor. «Ya tenemos una idea más clara de la toxicidad y lo que se hace es comparar sus resultados con los de otras medicaciones existentes». La última fase del ensayo es la previa a la comercialización.
«Nuestra actividad se basa en una piramide; en la cúspide está la seguridad del paciente, es lo que prima y tenemos que garantizarlo. Después, en la base tenemos dos aspectos importantes para el promotor: la calidad del procedimiento y la confidencialidad del paciente (todos los datos que enviamos deben ir cegados, son archivos codificados)», dice Sánchez. Además, es un sector que «mueve mucho dinero» por lo que la confidencialidad de los propios estudios es fundamental también para los laboratorios.
Blanca Sánchez | Farmacología Clínica
Para que se pueda abrir un ensayo clínico es necesario que esté evaluado por las agencias reguladoras (la Agencia Española del Medicamento, a veces también la europea), al tiempo que debe aprobarlo un comité de ética de investigación con medicamentos (CEIM). Después, la Gerencia del hospital tiene que dar el visto bueno al ensayo y firmar el contrato con el promotor, que es el que lo financia. «En Cantabria hay una cuarta pata que es el agente coodinador, el Idival. Por cada protocolo, en cada centro hay un investigador principal, que recluta a los pacientes del entorno hospitalario. Es él quien propone la idea al paciente, porque piensa que puede cumplir motivos de inclusión». Y en este sentido, la farmacóloga destaca que «tenemos unos equipos de investigación y de reclutamiento que nadie nos puede poner en duda. El capital humano es brutal».
Una vez se selecciona a los candidatos al ensayo, «en la Unidad les explicamos el protocolo de nuevo y hay que darles tiempo para pensarlo. Si se deciden, han de firmar el consentimiento informado. Siempre insistimos en que si tienen duda, mejor que no entren, aunque podrán retirarse en cualquier momento».
El equipo asignado al área de ensayos, dependiente del Servicio de Farmacología Clínica de Valdecilla, gestiona toda la planificación de las visitas marcadas en el protocolo y de los procedimientos incluidos en cada una de ellas, que «se tienen que realizar en tiempo y forma». Además de la agenda de pacientes, gestiona toda la medicación y las muestras de los pacientes. «Tenemos mucho ensayo en terapia biológica con anticuerpos monoclonales», que son creados en laboratorio para ayudar al sistema inmunitario a bloquear aquello que produce daño, es decir, a defenderse frente a la enfermedad. «Hemos tenido uno frente al asma con resultados realmente espectaculares. Estos fármacos biológicos cada vez tienen más aplicaciones. Por ejemplo, hemos testado monoclonales en migraña. Acabamos de empezar con ensayos oncohematológicos, aunque los ensayos en terapias avanzadas (terapia génica, que no son monoclonales) son el futuro».
Los ensayos clínicos realizados en el hospital suponen una importante fuente de ingresos para el Instituto de Investigación Valdecilla (Idival). Así, por ejemplo, de los 6,9 millones que generó esta actividad el año pasado, 1.182.394 euros van directamente a sus cuentas, según los datos facilitados por el director de gestión, Galo Peralta. Es decir, ser seleccionados por un laboratorio para experimentar con una nueva molécula, no solo abre la puerta a un potencial beneficio terapéutico para los pacientes elegidos (es cierto que no siempre lo hay), sino que también sirve para financiar futuras investigaciones.
Por contrato, el 30% de la financiación de los ensayos clínicos pasa a engrosar el presupuesto general del instituto, un 35% se destina a los investigadores, para que lo inviertan en proyectos, y otro 35% es utilizado para pagar a los colaboradores del estudio, esto es, al equipo de profesionales de la Unidad de Ensayos Clínicos, adscrita al servicio de Farmacología Clínica de Valdecilla, pero que cuenta también con personal flotante, como son los coordinadores de las áreas de investigación con más peso, y con profesionales contratados desde el Idival.
Publicidad
Publicidad
Te puede interesar
Publicidad
Publicidad
Esta funcionalidad es exclusiva para suscriptores.
Reporta un error en esta noticia
Comentar es una ventaja exclusiva para suscriptores
¿Ya eres suscriptor?
Inicia sesiónNecesitas ser suscriptor para poder votar.